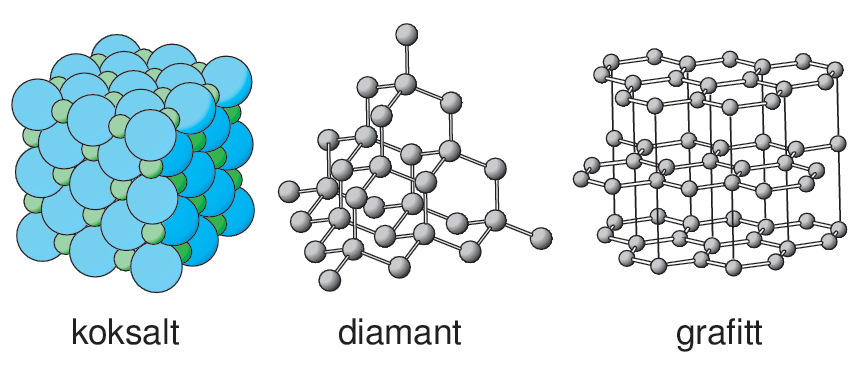
Kjemiske bindinger er kreftene eller «limet» som holder partiklene sammen i et stoff. Partiklene som blir holdt sammen kan være atomer, molekyler eller ioner.
Atomer er bitte små deler som alt stoff er bygget opp av.
I et molekyl er flere atomer bundet sammen med kjemiske bindinger.
Et ion er et atom eller et molekyl som er elektrisk ladet.